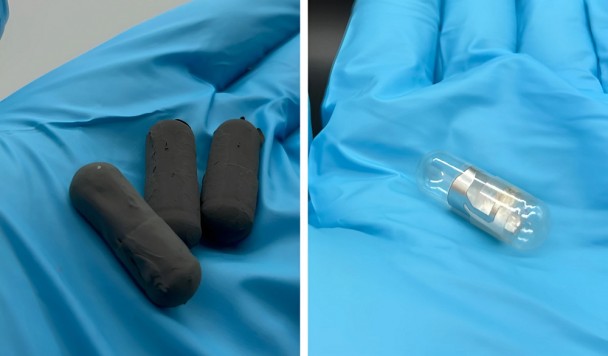
Что, если медицинский имплант сможет не просто доставлять лекарство, а вести себя как настоящий орган — чувствовать, реагировать и работать автономно? Именно к этому стремились инженеры Техниона — Израильского технологического института — и Массачусетского технологического института (MIT), когда начали эксперименты с так называемыми клеточными материалами, способными «слышать» химические сигналы внутри организма. Сегодня эта идея сделала большой шаг вперёд: исследователи представили имплант, который действует как автономная искусственная поджелудочная железа и непрерывно регулирует уровень сахара в крови без внешних помп и инъекций.

Разработка может радикально изменить жизнь людей с диабетом, избавив их от постоянного контроля и ежедневных уколов инсулина.
Как это работает
Проектом руководил доцент Шади Фарах с факультета химической инженерии Техниона, а в работе участвовали учёные из MIT, Гарвардского университета, Университета Джонса Хопкинса и Массачусетского университета. Итог их усилий — полноценная клеточная система, которая сама вырабатывает и доставляет инсулин, не требуя внешнего управления.
Миниатюрный имплант содержит живые клетки, производящие инсулин. Они заключены в особую защитную оболочку — кристаллический «щит». Устройство в реальном времени отслеживает уровень глюкозы и автоматически выделяет ровно столько инсулина, сколько нужно организму. По сути, оно имитирует работу здоровых бета-клеток поджелудочной железы. Здесь нет электронных датчиков или насосов: сами клетки одновременно выступают и сенсорами, и «фабрикой» гормона.
Закрытый биологический контур — когда система сама чувствует изменения и тут же на них реагирует — давно считается «святым Граалем» исследований диабета. Но почти все подобные попытки разбивались об иммунную систему: организм воспринимает имплантированные клетки как угрозу и уничтожает их за считаные недели.
Команда Фараха подошла к проблеме с инженерной изобретательностью. Они создали кристаллический щит — специально разработанную решётчатую структуру из терапевтических кристаллов. Этот каркас пропускает кислород и питательные вещества, необходимые клеткам для жизни, но при этом скрывает их от иммунного надзора. В результате клетки остаются «невидимыми» для защитных механизмов организма и продолжают работать.
Результаты испытаний
Концепцию проверили сразу в нескольких экспериментальных моделях. У мышей с диабетом имплант длительное время поддерживал стабильный уровень глюкозы в крови. В экспериментах на нечеловекообразных приматах устройство сохранило жизнеспособность клеток и их способность вырабатывать инсулин.
Такое сочетание результатов — устойчивость и функциональность у разных видов — редкость для подобных технологий. Фактически это один из первых случаев, когда автономная имплантируемая «поджелудочная» показала стабильную работу на разных биологических уровнях, что открывает путь к клиническим испытаниям на людях.
Шади Фарах начал развивать эту концепцию ещё во время постдокторской стажировки в MIT и Бостонской детской больнице, работая под руководством Дэниела Андерсона и Роберта Лангера. Лангер, известный также как сооснователь Moderna, давно продвигает идею объединения синтетических материалов и живых клеток в управляемые терапевтические системы.
Именно эта научная среда помогла превратить теоретическую идею «живого устройства» в конкретную инженерную задачу, над которой сегодня продолжают работать в лаборатории Фараха в Технионе при активном сотрудничестве с университетами США.
Пока основной фокус — лечение диабета, но потенциал технологии куда шире. Исследователи предполагают, что ту же платформу можно адаптировать для выработки других биологических препаратов: факторов свертывания крови при гемофилии, ферментов для лечения наследственных метаболических заболеваний и не только.
Если кристаллический щит и дальше будет эффективно защищать клетки от иммунной атаки, в будущем мы можем получить долговечные импланты — настоящие «живые фабрики лекарств», которые реагируют на биохимию организма в реальном времени.